東京大学の後藤由季子教授らの研究グループは16日、これまで機能に不明な点が多かった因子HMGA2がクロマチンを直接凝集させる活性を持つことを明らかにしたと発表している。クロマチンの凝集状態の違いによってゲノムDNAからの読み取りができるかどうか決まるため、凝集状態の制御は極めて重要だ。
研究チームはHMGA2が既知のクロマチン凝集因子H1と相互作用することを発見したことをきっかけに、HMGA2がクロマチン構造を直接制御する可能性を考えた。そこで精製したHMGA2とポリヌクレオソームを用い、生化学的な解析や原子間力顕微鏡による観察を行うことでHMGA2がクロマチン構造に与える影響を解析した。
その結果、HMGA2を加えることでポリヌクレオソームが凝集する様子が観察され、HMGA2はクロマチンを直接凝集させる活性があることを初めて明らかにしました。
この結果と一致して、次世代シーケンス解析、イメージング解析を用いることで、HMGA2は生体内においても凝集したクロマチンに存在することを見出した。さらにHMGA2 の遺伝子内部への結合は遺伝子発現の抑制と関連すること、また HMGA2 は液液相分離を起こすこと、なども発見。以上の結果からHMGA2はこれまでに知られていなかったクロマチン凝集因子であることが判明した。
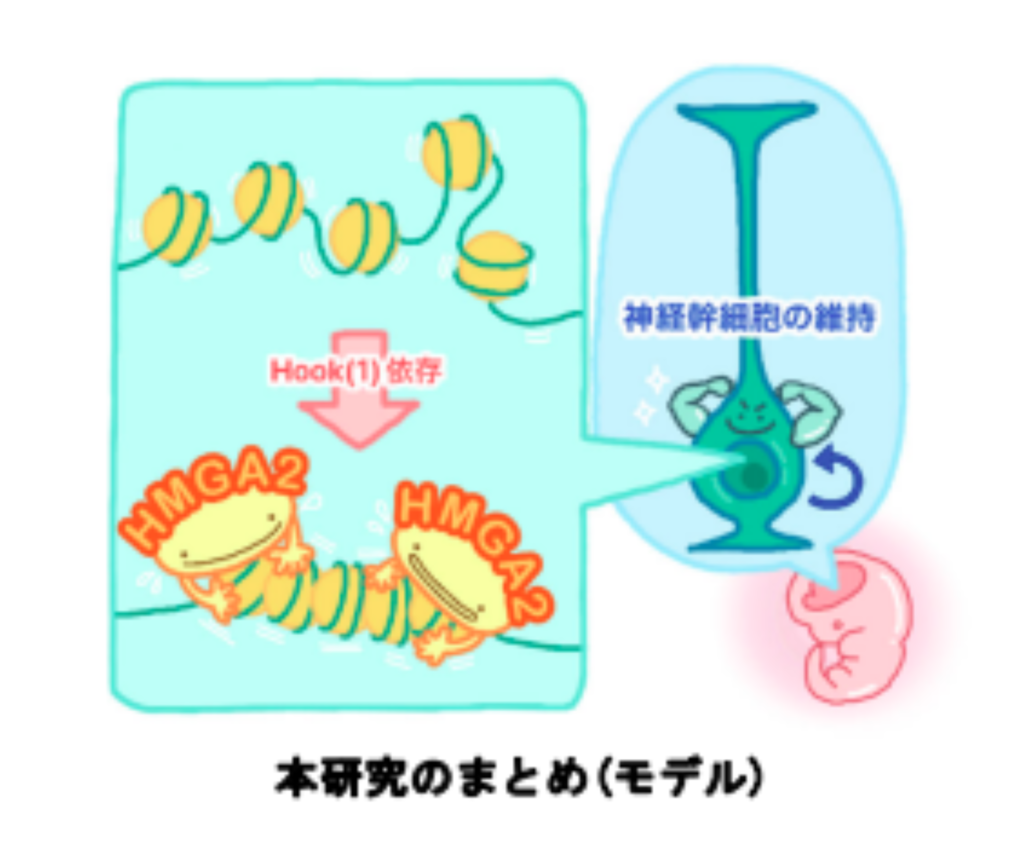
さらにHMGA2によるクロマチン凝縮がHMGA2の生理機能に貢献しているのかを検証。そこで、クロマチン凝縮の性質を欠失したHMGA2変異体の作成を試みた。その結果、HMGA2の一部であるhookドメインを欠失させることで、ヌクレオソームへの結合活性を維持したままHMGA2の凝集活性が失われることを明らかにした。そこでこのhook欠失変異体を用いて、HMGA2のクロマチン凝集活性が、どのような細胞機能に貢献するか検証しました。
この結果、全長のHMGA2を強制発現した場合、分裂を続ける神経前駆細胞の割合が増加したのに対し、hook1を欠損したHMGA2の過剰発現ではこの効果は見られませんでした。重要なことに、クロマチン凝集活性を失ったhook1欠損HMGA2に対して強制的に凝集を誘導した場合、全長のHMGA2の過剰発現と同様に神経幹細胞の維持効果がみられた。このことから、HMGA2による神経幹細胞の維持効果はクロマチン凝集活性に依存していることが分かっている。
研究チームは「本研究はクロマチン凝集因子のリストに新しくHMGA2を加えたという点で大きな意義がある。研究はこれらの幅広い現象の理解、ひいては疾患の治療法の確立につながることが期待される」としている。